「紫陽花に誘われ坂を上りけり」
雨の中に咲く紫陽花がきれいな季節となりました。
今月もK&Tファーマコンサルティングは製薬企業の皆様に少しでもお役に立てるよう鋭意努めて参りたいと思います。
さて、イノベーションを求められる製薬企業にとっては、下記の項目が主な課題として挙げられます。
・創薬研究(新しい治療法の探索と創薬力)
・開発(治験規制等の変化への対応とDX活用による効率化/患者負担の軽減)
・東南アジアをはじめとする新興国での市場参入とシェア拡大
・希少病薬事業
・医療のアクセシビリティの向上
・医師の働き方改革への対応
・デジタルヘルスケアの拡大
・AI活用による効率化と付加価値のより一層の向上
・MRの営業活動の変化と本部機能の役割分担
・人材開発とトップタレントの育成
・製薬産業全般におけるDXの急激な進展と対応
・持続可能性の追求
・生産・物流の変化
これらの課題について考察する前に、私自身一度「COVID-19感染拡大と製薬産業」について一旦総括する必要があると考えています。
下記文章は、私の原稿(2022年9月出版)の一部をご紹介するものです。ご参考までに5回シリーズで発信したいと思います。
第1回は、医療・医薬品市場と製薬企業の業績への影響を中心とした内容で、第2回は、コロナワクチンの研究において、なぜ日本で創薬できなかったのかについて考察しました。今回(第3回)は、開発についての状況です。
開発
コロナ禍にあって,各製薬企業の開発はどのような影響を受けたのであろうか。IQVIA による製薬企業上位50 社の臨床試験継続状況調査(n=33,公式に声明を出している会社)によれば,COVID-19 が拡大する中にあって,対策を講じ臨床試験の現状維持を予定している製薬会社は全体の70%を占め,新規試験を延期および進行中の患者登録を中断している企業は21%,新規試験のみ延期6%,進行中の患者登録を中断は3%であった。
臨床試験の流れは,図12-5 の通りである。CRO とはContract ResearchOrganizationの略で開発業務受託機関と呼び,製薬企業から医薬品開発における臨床試験業務を受託している企業である。
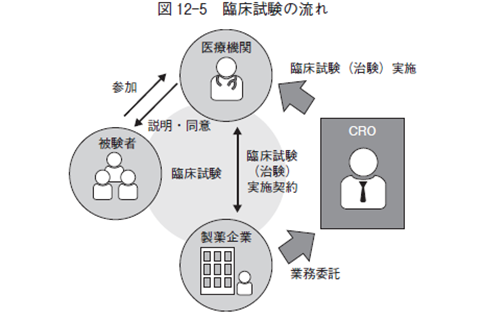
今回のCOVID-19 の感染拡大により医療機関,被験者,製薬企業,CROのそれぞれが影響を受けた。医療機関は患者(被験者)の安全第一を考慮し, また被験者は病院への通院に懸念を示し, 製薬企業, CROは病院(臨床治験施設)への訪問が困難になり,結果として治験が遅延するケースが発生した。
COVID-19 感染拡大下の臨床試験における主な課題についてIQVIA 調査(グローバル/医療施設,n=138)によれば,患者にいかに治験を継続してもらえるか,ということがトップであった。治験参加中の患者のフォローアップのほか,患者の安全第一を考えて医療機関が苦悩する様子が良くわかる。さらに,治験に専念する医療機関側のスタッフが様々なコロナ対応に時間を割かれ,治験候補患者を探索(自施設のデータベース/診療録のレビュー)する時間がない,治験のためのデータ入力等に時間が割けない,などの意見がある。患者自身が治験のために施設を訪問することを控えることに加えて,治験施設でのコロナ対応によるスタッフ不足も課題となっている。
図12-6 はIQVIA による,治験データの検証を遠隔でできる医療機関の割合について,諸外国と日本を比較した調査結果である。これによればアメリカは断然トップで60%強の医療機関で遠隔による治験データの検証ができるが,日本は世界の中で最も低く10%以下である。COVID-19 の感染拡大により,最も影響を受けた国は日本といっても過言でない。
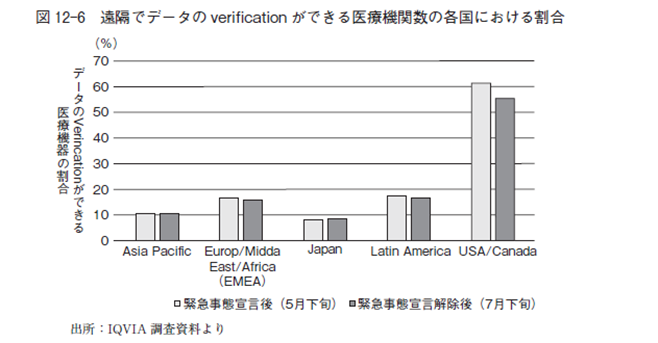
表12-2 は,日本におけるこれまでの治験の課題についてまとめたものである。日本は諸外国に比してCRA※(モニター)の施設への訪問回数が多く,紙媒体中心で生産性が著しく低い。これらはコロナ禍にあって露見したものである。ウィズコロナ・ポストコロナのニューノーマルを展望した時に,日本の治験においてもデジタル化を加速せざるをえないことを示唆している。従来型の臨床開発からリモート/バーチャルがキーワードとなる。※clinical research associate の略で,モニター(臨床開発モニター)とも呼ばれ,治験に関する治験契約,モニタリング業務,CRF(case report form:症例報告書)チェック・回収,治験終了の諸手続きなどを行う専門職である。

CROにてCRA(モニター)業務を担当している担当者2 人に,コロナ禍の臨床治験の現場で,実際にどのような課題があったのか,またこれを機にチャンスととらえられるものが展望できたのか,約1 時間のインタビューを行った。
治験の最前線で働いているN さんとF さんは,入社4~5 年目でCRA という業務についている。CRO に勤務するCRA(モニター)の主務は,製薬会社からの依頼を受けて臨床試験に関わる医師,被験者,CRC※と連携しながら被験者である患者のカルテデータが申請時必要となる電子媒体へ正確に移行(EDC9)されているかの確認・チェックを行うことである。担当施設はそれぞれ6 施設,10 施設である。※crinical research coordinator の略で治験実施医療機関において,治験責任医師のもとで治験に係る業務に協力する薬剤師,看護師,その他の医療関係者をいう。
2 人のインタビュー結果をまとめると下記の通りである。
コロナ禍の治験業務に関しては,はじめに被験者である患者さんが病院での感染リスクを恐れて来ない事態が発生した。特に都内の大病院については患者さんがかなりナーバスになっており,電話にて安全性について確認するが薬剤投与はできない。患者さんの意思を尊重し,一部治験データはスキップとなる。データがスキップされた場合にはそれをきちんと理由を添えて記録を残さなければならない。一方,希少疾患等で治験に参加している患者さんは,コロナのリスクよりも治療を優先する関係で,治験に遅延は出ていない。
データ確認・管理のための医療機関訪問が一部できなくなった。コロナ前は通常通り病院を訪問し,治験薬の残薬を数えたり,EDC※ をカルテと照合しボタンを押すことで治験データを正確に保存する作業を行っていた。これらが遅延すると当初のプランが遅れ申請,承認が遅れることにつながる。先生(医師)の中にも他人に感染を広げないことを理由にモニターが訪問することを拒まれる方(特に東京から地方の施設訪問時)がいて,先生やCRCとの打ち合わせや製薬企業担当者との打ち合わせは,ほとんどウェブとなった。ただ,先生がウェブでの面談を希望していても院内の治験委員会がこれを承認しないなどの事例もあった。※electronic data capture の略で治験の担当医師,スタッフが臨床検査値の治験データを初期段階から電子的に収集し管理することをいう。
またEDC の閲覧時間が制限されるようになった。以前は2 人で訪問したりしたがコロナ禍では人数制限がある。いままで定期的にタイムリーに行けたところが,短時間でかなりのクオリティでやらなければならなくなった。製薬企業でも外資系と内資系とで,リモート面談に差があった。外資系は在宅勤務やウェブ会議や電子署名についても慣れていたが,内資系ははじめの頃はかなりとまどっていた印象がある。
一方,コロナ禍において以前と比べプラスになった面もある。先生方への治験の依頼については,いままでは病院の診療科を訪問,説明してお願いするのが常であったが,これをウェブで対応でき業務の効率化が図られた。
まったく初めての先生とのウェブ面談については,治験施設のCRC にお願いして先生に取り次いでいただいた。可能であれば,はじめの1 回目だけは先生にごあいさつに行くことを心がけた。これにより次回からのウェブ面談がスムーズになった。
また緊急事態宣言下どうしても病院を訪問できない場合には,CRC から先生にお話しいただき,ウェブでの面談について了解をとった。先生方も最近はウェブ面談になれておられ,初めてお会いする先生ともスムーズにいった。この辺はコロナ禍以前よりも遥かにポジティブなものとしてとらえることができる。
上記インタビューによれば,コロナ禍にあってマイナス面ばかりが強調されることが多いが,いままでまったく面識がない先生方との,初めてのウェブ面談もスムーズに可能となり,プラス面もあったとのことである。医薬のMR は,初めての先生方とのウェブ面談はかなり難しいが,CRA という職種のためか,初めての先生方とも比較的スムーズにウェブ面談をこなしている事実の発見は有意義であった
次回に続く。
